|
| |||
|
Týdeník věnovaný aktualitám a novinkám z fyziky a astronomie. | |||
|
Slibné vyhlídky borové radioterapie
Vladimír Scholtz
BorBor – Borum, nejlehčí z III. hlavní skupiny prvků. Svými vlastnostmi leží na hranici mezi kovy a nekovy. Byl izolován roku 1808 sirem Humphry Davyem, Gay-Lusacem a L. J. Thénardem v nepříliš vysoké čistotě a teprve roku 1824 ho Jakob Berzelius označil za samotný prvek. Využívá se v metalurgii a sklářském průmyslu. jako pátý prvek Mendělejevovy periodické soustavy prvků má mnoho zajímavých vlastností. Využívá se například ve sklářství při výrobě borokřemičitanových skel, která mají skvělé tepelné vlastnosti. Používá se také pro zpomalení neutronů v jaderné energetice. V dnešním bulletinu se budeme zabývat jeho možným využitím v medicíně při radioterapiiRadioterapie – metoda léčby využívající destruktivních účinků ionizujícího záření na buňky živých tkání. nádorů.
Obr. 1: Bor 10B a izotop 11B.
|
Bor – Borum, nejlehčí z III. hlavní skupiny prvků. Svými vlastnostmi leží na hranici mezi kovy a nekovy. Byl izolován roku 1808 sirem Humphry Davyem, Gay-Lusacem a L. J. Thénardem v nepříliš vysoké čistotě a teprve roku 1824 ho Jakob Berzelius označil za samotný prvek. Využívá se v metalurgii a sklářském průmyslu. Radioterapie – metoda léčby využívající destruktivních účinků ionizujícího záření na buňky živých tkání. Ionizující záření – jakékoli radiační pole, jehož kvanta mají dostatečnou energii, aby ionizovaly atomy a molekuly. V biomedicíně musí proniknout do těla a ionizovat biomolekuly. |
Radioterapie a ionizující záření
Ionizujícím zářením označujeme jakékoli pole, které je schopné přímo nebo
nepřímo ionizovat atomy podél své dráhy. Tradičně se jako ionizující záření
označují rentgenové záření,
gama záření,
alfaAlfa částice – jádro helia, vázaný stav dvou protonů a dvou neutronů. Přirozenou cestou vzniká při alfa rozpadu. Vzhledem k velké vazebné energii jde o vysoce stabilní částici. a beta zářeníBeta rozpad – β−: rozpad neutronů v atomovém jádře, jehož výsledkem je elektron, proton a elektronové antineutrino (slabě interagující antilepton).
β+: rozpad protonů v atomovém jádře, jehož výsledkem je pozitron (antičástice k elektronu), neutron a elektronové neutrino. a neutronovéNeutron – částice složená ze tří kvarků (ddu) se spinem 1/2, hmotností 1,675×10−27 kg (940 MeV) a nulovým elektrickým nábojem. Volné neutrony jsou nestabilní se střední dobou života 886 s (15 minut) a poločasem rozpadu 10 minut. V roce 1930 Walther Bothe a Herbert Becke ostřelovali lehké prvky alfa částicemi a objevili nový druh pronikavého záření. V roce 1932 zjistil James Chadwick, že je toto záření složeno z neutrálních částic přibližné velikosti protonu a objevil tak neutron. záření.
První dvě mají elektromagnetickou povahu, je to tedy proud fotonůFoton – základní kvantum energie elektromagnetického záření, polní částice elektromagnetické interakce. Má nulovou klidovou hmotnost a nemá elektrický náboj. Jeho energie a hybnost jsou přímo úměrné frekvenci záření (E = ħω, p = E/c). Stav fotonu zahrnuje také polarizaci, protože jde o příčné vlnění. Kvantování energie poprvé zavedl Max Planck při pokusech o vysvětlení záření černého tělesa. Albert Einstein dal těmto kvantům reálný význam v roce 1905 při vysvětlení fotoelektrického jevu. Samotný název foton poprvé pro tuto částici použil až americký fyzikální chemik Gilbert Lewis v dopise časopisu Nature z roku 1926.; zbylé tři
souvisí s jinými elementárními částicemi, než jsou fotony. Jak je známo a již
dlouhou dobu používáno, ionizující záření má negativní účinky na živé buňky. K poškozování může docházet přímou ionizací nebo excitací makromolekul, nebo
nepřímo, kdy jsou radiolýzou vody generovány volné radikály. Na buněčné úrovni
dochází zejména k poškozování různých makromolekul jako jsou
bílkovinyBílkoviny – proteiny, vysokomolekulární biopolymery aminokyselin s molekulovou hmotností tisíc až milión. Tvoří strukturální i funkční podstatu živé hmoty. nebo
enzymyEnzymy – jednoduché či složené bílkoviny, které katalyzují chemické přeměny v živých organizmech., což obvykle naruší jejich funkčnost. Buňka je však obvykle schopna je
zlikvidovat a vytvořit nové. Závažnější jsou poškození, která již buňka není
schopna opravit a dochází k jejímu trvalému poškození, typicky jde o silná
poškození makromolekul
DNADNA – Deoxyribonucleic acid, deoxyribonukleová kyselina. Jde o nukleovou kyselinu, jejíž cukernou složkou je 2'-deoxyribóza. Báze jsou tvořeny především čtveřicí adenin, thymin, guanin a cytosin; vzájemně komplementární jsou nukleotidy s adeninem a thyminem, a nukleotidy s cytosinem a guaninem. DNA vytváří dvoušroubovici z navzájem komplementárních opačně orientovaných řetězců, pracovního a paměťového. Její hlavní funkcí je uchovávání genetické informace. a RNARNA – Ribonucleic acid, ribonukleová kyselina. Jde o nukleovou kyselinu, jejiž cukernou složkou je ribóza, nukleotidy jsou obdobné jako v DNA, pouze báze thymin je nahrazena uracilem, který také umožňuje komplementaritu s adeninem. Hlavní funkcí RNA je přenos informace z DNA do
dalších struktur. Na rozdíl od DNA dvoušroubovice není typickou strukturou RNA.. U mnohobuněčných organizmů poškozená buňka
zahyne, nebo je její poškození rozpoznáno imunitním systémem, který ji zahubí. V ojedinělých případech však může tato ochrana selhat a buňka se zvrhne v nádorovou s následným rozvojem nádorového bujení. To může být
benigní, kdy
dochází jenom k nekontrolovanému ale izolovanému nárůstu nádoru, nebo maligní,
kdy dochází k přerůstání nádoru i do jiných tkání. Při maligním nádoru dochází
obvykle k poškozování okolních tkání, časté je také metastázování, kdy se buňky
z nádoru uvolňují a aktivně nebo pasivně přecházejí na jiné místo organizmu, kde
bujení dále pokračuje.
Obecně platí, že nejvnímavější jsou k poškození rychle se dělící buňky jako například kostní dřeň, střevní epitel, játra, embryo a samozřejmě buňky nádorové. A právě na této vlastnosti nádorových buněk je založena radioterapieRadioterapie – metoda léčby využívající destruktivních účinků ionizujícího záření na buňky živých tkání. nádorových onemocnění. Aniž bychom zde měli zájem tuto velice rozsáhlou oblast medicíny dopodrobna vysvětlovat, zmíníme, že nádorové buňky jsou naštěstí obvykle citlivější k poškození než buňky zdravé. S přijatou dávkou záření se pravděpodobnost fatálního poškození buňky zvyšuje, přičemž je důležité, aby byla víc poškozena nádorová buněčná tkáň než okolní zdravá tkáň. Při léčbě nádorů je tedy snaha o to, aby bylo co nejvíc záření absorbováno v nádoru a co nejméně v okolních tkáních. Toto je možné zabezpečit vhodným druhem záření a geometrií ozařování organizmu – tedy nádorové tkáně i všech okolních tkání. Obecně je tuto vlastnost možno vystihnout závislostí na obrázku 2, kde soupeří dva faktory. Při zvyšování dávky stoupá pravděpodobnost chtěné úspěšné eliminace nádorové tkáně, ale také nechtěného postižení zdravých tkání a tedy komplikací. Vynásobením pravděpodobnosti zničení nádoru a pravděpodobnosti průběhu bez komplikací získáme výslednou pravděpodobnost úspěšné terapie, kde je vidět optimum pro úspěšnou léčbu. Z uvedeného je patrné, že při ozařování je veliký zájem na tom, aby se co nejvíce záření absorbovalo v nádorové tkáni a ne v té okolní.
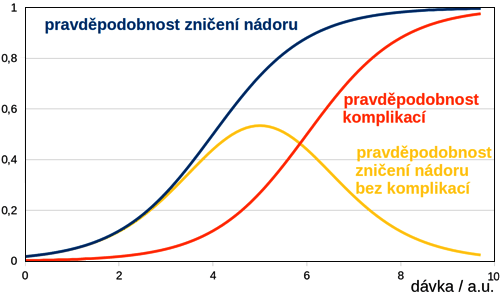
Obr. 2: Průběh pravděpodobností pro zničení nádoru, výskyt komplikací
a úspěšnou léčbu v závislosti na dávce záření v tkáních.
Borová terapie
Při ozařování elektromagnetickým záření (RTG, gama) dochází v látce pouze k nepružným srážkám fotonů záření s částicemi, přičemž při srážce je foton částicí absorbován a jeho energie je jí předána. Intenzita tohoto záření při průchodu materiálem klesá exponenciálně, nejvíce se absorbuje na povrchu materiálu a dál intenzita rychle klesá. Naproti tomu, při ozařování částicemi, je absorpce nejvyšší až ke konci dráhy částice, toto maximum se nazývá Braggův pík. Podrobně jsme o tom psali v AB 27/2021.
Ke zvýšení absorpce záření v nádorových buňkách je možno využít i látek, které zvyšují absorpci záření a přednostně se zachytávají v nádorových buňkách. Může se jednat o látky obsahující bor, který výrazně zvyšuje účinný průřez pro neutrony a je využíván v boro-neutronové záchytné terapii, ale o tom jsme ve zmíněném bulletinu už také psali.
V nejnovějších pracích se ale ukazuje, že bor je možné použít nejenom při ozařování neutrony, ale i ke zvýšení účinnosti protonové terapie. Při srážce protonu s borem může dojít k protono-borové fúzní reakci, ve které je proton úplně absorbován izotopem boru 11B. Tuto reakci je možné souhrnně zapsat jako p + 11B › 3?. Skládá se však ze tří postupných reakcí, první je fúzní reakce, kde vzniká uhlík 12C fúzí s protonem p + 11B › 12C. Ten se následně rozpadá reakcí 12C › 8Be + ? a další reakcí 8Be › 2?, viz obrázek 3.
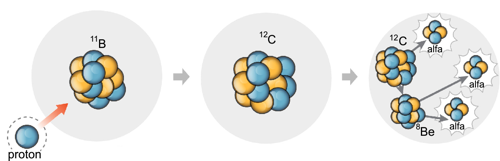
Obr. 3: Protono-borová fúzní reakce. Zdroj: Oncotarget.
Výhody protono-borové záchytné terapie
Tato proton-borová záchytná terapie by mohla výrazně zlepšit dosavadní protonovou léčbu, jak ukazuje práce [2]. Borokaptát sodný (Na2B12H11SH) s izotopem boru 11B je primárně absorbován nádorovými buňkami a po fúzi s protonem vznikají beze zbytku tři částice ?. Ty mají ve tkáních jenom krátkou dráhu, menší než cca 10 µm, což je přibližně rozměr jedné buňky a nedochází tedy k poškození okolních buněk. Oproti klasické protonové terapii dochází ke zvýšení absorpce protonů uvnitř nádorových buněk ve srovnání s buňkami zdravými. Navíc, na rozdíl od jednotlivých protonů, ? částice způsobují častěji větší neopravitelné poškození DNA. Jak ukazuje obrázek 4, jeden proton záření je obvykle schopen způsobit pouze jednoduché poškození DNA. Naproti tomu ? částice mnohem častěji způsobuje kumulované poškození, tedy zlom na více místech, které už buňka není schopna opravit. Ve výsledku je poškození buněk oproti klasické protonové terapii výrazně posíleno jak větším poškozením DNA ? částicemi, krátkým doletem ? částic, tak i skutečností, že na jeden proton z klasické terapie připadají až tři ? částice. V ideálním případě tedy vznikají na jeden proton tři kumulativní poškození ve srovnání s jedním jednoduchým.
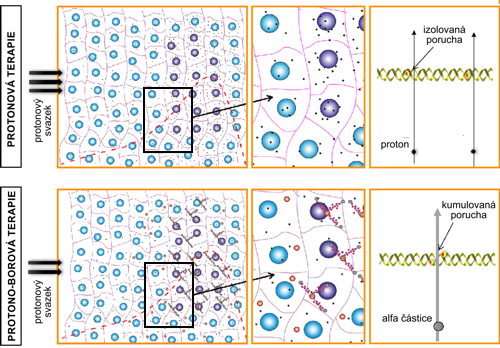
Obr. 4: Srovnání klasické protonové terapie (nahoře) a protono-borové terapie (dole). Na levém obrázku jsou znázorněny zdravé (modré) a nádorové (fialové) buňky a Braggův pík absorbovaných protonů. Při klasické protonové terapii vznikají většinou izolované, jednoduché poruchy DNA, při protono-borové terapii vznikající ? částice způsobují většinou kumulované poruchy DNA. Převzato a upraveno z [2].
Při zmiňované fúzní reakci dochází i ke generování okamžitého ? záření o energii 719 keV [3] (jiné práce uvádí 718 keV [4]). Protože k záchytu dochází převážně v nádorových buňkách, vzniká tam i toto záření a poskytuje informaci o tom, kde se přesně nádor nachází. Toho by mohlo být úspěšně využito v adaptivní nádorové terapii, která pro přesnější cílení radioterapie průběžně mapuje i polohu a velikost nádoru. To zatím sice jen jako výstup Monte CarloMonte Carlo – skupina numerických metod využívající náhodná čísla a náhodné procesy. Ke nejznámějším patří například Metropolisova metoda. simulace ukazuje práce [5]. Pro simulaci autoři použili protonový svazek o energii 90 MeV, který namířili do válcového fantoma o průměru 20 cm a výšce 10 cm naplněného vodou, ve kterém byly umístěny čtyři válcové oblasti o průměru 4 cm a výšce 2 cm jako reprezentace nádorů. V oblastech nádorů byla nastavena zvýšená koncentrace boru 20 µg/g, což je hodnota obvykle používaná při léčbě v neutronové terapii [6]. Koncept tohoto uspořádání pro klinickou praxi a v popisovaném modelu ukazuje obrázek 5.
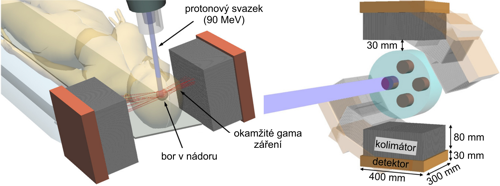
Obr. 5: Koncept uspořádání pro detekci okamžitého gama záření pro adaptivní nádorovou terapii v možné klinické praxi (vlevo) a v popisovaném modelu (vpravo). Převzato a upraveno z [5].
Výsledky simulace ukazují, že v popsaném potenciálně realizovatelném experimentu je opravdu možné záchytem okamžitého gama záření získat aktuální informaci o velikosti a poloze nádoru. Jak ukazují výsledky zobrazené na obrázku 6, je touto metodou možné jak zobrazení původních nádorů, tak i jejich simulovaných posunů a změn velikostí.

Obr. 6: Nákres poloh a velikostí oblastí
se zvýšenou koncentrací boru a jejich
zobrazení záchytem okamžitého ?
záření. Převzato a upraveno z [5].
Jak by mohl laskavý čtenář očekávat, uvedené nové metody by mohly výrazně zvýšit účinnost a úspěšnost radioterapie nádorů. Zatím však jde pouze o výsledky laboratorních experimentů nebo počítačových simulací, a proto je jistá opatrnost vždy namístě.
Odkazy
- David Zoul: Radiace, která léčí – část čtvrtá; AB 27/2021
- G. A. P. Cirrone et al.: First experimental proof of Proton Boron Capture Therapy (PBCT) to enhance protontherapy effectiveness; Nature Scientific reports 8/1141 (2018) 1–15
- Joo-Young Jung et al.: Comparison between proton boron fusion therapy (PBFT) and boron neutron capture therapy (BNCT): a Monte Carlo study; Oncotarget 8/24 (2017) 39774–39781
- L. Giuffrida et al.: Prompt gamma ray diagnostics and enhanced hadron-therapy using neutron-free nuclear reactions; AIP Advances 6/10 (2016) 105204
- Min-Geon Choi et al.: Daily adaptive proton therapy: Feasibility study of detection of tumor variations based on tomographic imaging of prompt gamma emission from proton–boron fusion reaction; Nuclear Engineering and Technology 54/8 (2022) 3006-3016
- Takao Tsurubuchi et al.: Evaluation of a Novel Boron-Containing ?-d-Mannopyranoside for BNCT; Cells 9/5 (2020) 1277
