|
| |||
|
Týdeník věnovaný aktualitám a novinkám z fyziky a astronomie. | |||
|
Návrat planetárního modelu atomu
Petr Kulhánek
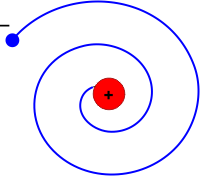
Na přelomu 19. a 20. století se lidstvo svou experimentální technikou dostalo tak daleko, že bylo schopné pozorovat jevy souvisící s atomární podstatou látky. Klasická mechanika a teorie elektřiny a magnetizmu při popisu takových dějů selhávala. Bylo nemožné popsat tepelné záření látek, fotoelektrický jev, vlnové chování částic i mnoho dalších jevů. Velkým problémem byla i existence atomů samotných. Když Rutherford svými experimenty v roce 1911 prokázal, že atomy mají malé kompaktní, kladně nabité jádro, bylo jasné, že elektronyElektron – první objevená elementární částice. Je stabilní. Hmotnost má 9,1×10−31 kg a elektrický náboj 1,6×10−19 C. Elektron objevil sir Joseph John Thomson v roce 1897. Existenci antičástice k elektronu (pozitron) teoreticky předpověděl Paul Dirac v roce 1928 a objevil Carl Anderson v roce 1932. jsou nějakým způsobem lokalizovány v jeho okolí. K popisu se přímo nabízel planetární model, ve kterém by elektrony kroužily kolem jádra stejně jako planety ve sluneční soustavě obíhají kolem Slunce. Jenže podle klasické elektrodynamiky nabitá částice, která mění svou rychlost (postačí jen směr) nutně září. Elektrony kroužící kolem jádra by ztrácely zářením energii a po spirále se blížily k jádru. Dopadly by na něho za dobu kratší než 10–10 s. Podle klasické elektrodynamiky by tedy atomy vůbec nemohly existovat.
|
Kvantový stav – soubor pozorovatelných parametrů kvantového systému, kterými je systém plně charakterizován. Popis stavu musí respektovat omezení kvantové mechaniky na současnou měřitelnost či neměřitelnost veličin. Například základní energetický stav atomu značíme symbolem |S>, vakuový stav symbolem |0>, živou kočku označíme |Ž>, mrtvou kočku |M> a podobně. Kvantový stav je zpravidla charakterizován sadou kvantových čísel a je matematicky vyjádřen tzv. vlnovou funkcí (prvkem Hilbertova prostoru stavů). Kvantové číslo, hlavní – značíme n, čísluje energii systému En. Hodnota energie závisí na průběhu potenciální energie. Energie je proto jinak kvantována ve vodíkovém atomu, jinak v harmonickém oscilátoru, kvantové jámě, atd. Kvantové číslo, vedlejší – značíme l, vyjadřuje maximální možnou projekci momentu hybnosti do nějaké osy v jednotkách redukované Planckovy konstanty. U atomu vodíku nabývá vedlejší kvantové číslo hodnot 0, 1, ... n–1. Časté je označování vedlejšího kvantového čísla písmeny s, p, d, f..., které odpovídají hodnotám 0, 1, 2, 3... Velikost momentu hybnosti (nikoli projekce) je dána vztahem L2 = l(l+1)ħ2. Kvantové číslo, magnetické – značíme m, čísluje projekci momentu hybnosti do libovolného směru. Ta může nabývat celistvých násobků Planckovy konstanty ħ, tedy Lk = mħ. Rydbergův atom – atom excitovaný do vysokého hlavního a vedlejšího kvantového čísla. Rydbergovy atomy jsou velmi citlivé na okolní elektrická a magnetická pole. Elektronová vlnová funkce může být u některých superpozic stavů těchto atomů aproximována klasickým pohybem elektronu po kružnici. Vysoce excitované atomy jsou pojmenovány podle švédského fyzika Johannese Roberta Rydberga (1854–1919). |
Bohrův model
Jistým řešením byl Bohrův model atomu (1913). Elektrony se v atomárních obalech nesměly pohybovat po libovolných drahách, ale jen po určitých drahách splňujících do modelu z vnějšku dodaná pravidla. Z dnešního pohledu šlo o kvantování momentu hybnosti, elektron se mohl vyskytovat jen na takové dráze, kde byla jeho projekce momentu hybnosti do určité osy rovna celistvému násobku Planckovy konstanty ħ. Jinou představu o Bohrově modelu získáme z duality vln a částic. Elektron se může někdy projevovat jako částice a někdy jako vlna. V Bohrově modelu musí být vlnová délka této vlny celistvým násobkem obvodu „povolených“ drah, tedy vlna se beze zbytku jakoby namotává na obvod dráhy. Podle Bohrova modelu elektron na těchto vyvolených drahách nezáří. K vyzáření může dojít jen při přeskoku elektronu mezi dvěma jeho možnými drahami. Bohrův model byl úžasným spojením planetárního modelu s magií povolených a nepovolených drah.
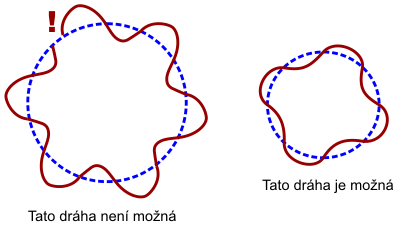
Bohrův model úspěšně popsal spektrum atomu vodíkuVodík – Hydrogenium, je nejlehčí a nejjednodušší plynný chemický prvek, tvořící převážnou část hmoty ve vesmíru. Má široké praktické využití jako zdroj energie, redukční činidlo při chemické syntéze a v metalurgii nebo jako náplň balonů a vzducholodí. Vodík objevil roku 1766 Henry Cavendish., nicméně pro popis dalších kvantových systémů musela vzniknout regulérní kvantová teorie, ať již založená na Schrödingerově vlnové rovnici nebo na Heisenbergově maticové mechanice. Kvantová teorie určuje jen pravděpodobnost výskytu elektronu v atomárním obalu a neřeší jeho konkrétní trajektorii, ta v kvantové teorii ztrácí smysl. Podle Heisenbergových relací neurčitosti nemůžeme nikdy současně poznat polohu částice a její hybnost. To nám znemožňuje používat nadále pojem polohy elektronu v atomárním obalu.
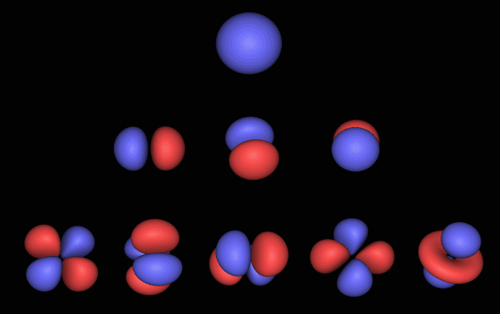
Atomární orbitaly – pravděpodobnosti výskytu elektronu
v atomárním obalu
podle kvantové teorie. Zdroj: Alex M. Clark, Chemical Computing Group
Inc.
Klasická limita
Se zvětšováním rozměrů mikroskopických systému se kvantové jevy postupně vytrácejí a přecházejí v klasickou fyziku. Nikdo by například neočekával pozorovatelné kvantování momentu hybnosti u otáčejícího se kola automobilu. Je nějaká podobná limita možná i pro atomární obaly? Rozměry běžných atomů v základním stavu jsou kolem 10–10 m. Existují ale i atomy, ve kterých jsou elektrony vybuzené do vysokých energetických stavů (tzv. Rydbergovy atomy). Takové atomy je možné najít v hlubinách vesmírného prostoru – pozorováno bylo například záření atomu vodíku s frekvencí 2,4 GHz, které odpovídá přechodu mezi hlavními kvantovými čísly 109 a 108. Průměr tohoto atomu vodíku je 1,2 μm. Dnešními technologiemi je možné připravit i atomy s rozměry blížícími se jednomu milimetru. Podle teorie by některé stavy elektronu v atomárním obalu takových rozměrů mělo být možné aproximovat klasickou fyzikou, tj. kvantové rozdělení pravděpodobnosti výskytu elektronu by mělo mít charakter lokalizovaného vlnového balíku.
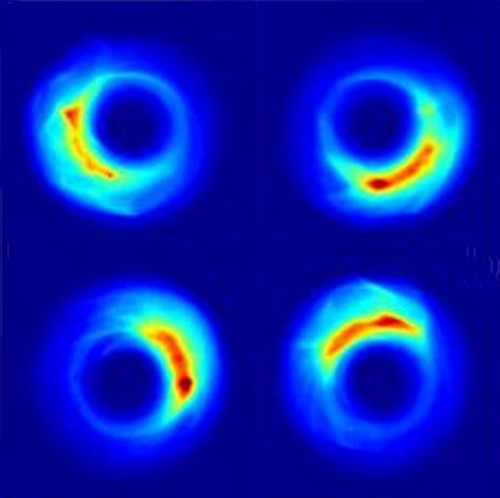
Lokalizované orbity. Zdroj: Jeff Mestayer, Rice University.
Skutečný průlom nastal v roce 2008, kdy se kolektivu pracovníků Univerzity v Rice pod vedením Barry Dunninga (ve vědeckém týmu byli zastoupeni i fyzici z Národní laboratoře v Oak Ridge a Vídeňské technické univerzity) podařilo nejen takové atomy vytvořit, ale dokonce i manipulovat s elektrony v atomárním obalu! Využili k tomu vysoce excitované atomy draslíkuDraslík – Kalium, velmi důležitý a reaktivní prvek ze skupiny alkalických kovů, hojně zastoupený v zemské kůře, mořské vodě i živých organizmech. Draslík je měkký, lehký a stříbrolesklý kov, který lze krájet nožem. Volný kov se poprvé podařilo připravit roku 1807 siru Humphry Davymu.. Za pomoci laserovéhoLASER – Light Amplification by Stimulated Emission of Radiation, zesílení světla pomocí stimulované emise záření. Roku 1958 ukázal Charles Hard Townes spolu s Arthurem Leonardem Schawlowem, že je možné zkonstruovat podobné zařízení jako již existující MASER (pracuje v mikrovlnné oblasti) také pro světlo. První laser zkonstruoval Theodore Harold Maiman v roce 1960. Aktivním prostředím byly ionty chrómu v syntetickém rubínovém krystalu. svazku a přesně cílených impulzů elektrického pole se jim podařilo přimět atomy přejít do stavu, ve kterém měly elektrony vysoce lokalizované vlnové funkce s maximem pravděpodobnosti obíhajícím po kruhové dráze. Elektrony zůstaly v těchto gigantických atomech lokalizovány po několik oběhů a chovaly se jako klasické částice. Význam takového objevu lze jen těžko předvídat. Uplatnění může samozřejmě najít v kvantových počítačích, při studiu kvantového a klasického chaosu a v různých specializovaných technologiích.
Klip týdne: Lokalizovaný elektron v atomárním obalu
Lokalizovaný elektron v atomárním obalu. V běžných atomech platí pravidla kvantové teorie a elektrony mají nenulovou pravděpodobnost výskytu v různých místech atomárního obalu. Tyto pravděpodobnosti vytvářejí tzv. orbitaly. U elektronu nemůžeme současně znát jeho polohu a hybnost. Uměle lze ale vytvořit vysoce excitované atomy (tzv. Rydbergovy atomy), které mají velikost téměř 1 mm. V takových atomech lze pomocí laseru a cílených impulzů elektrického pole připravit elektrony na lokalizovaných drahách. Elektrony se po několik oběhů chovají jako klasické částice obíhající atom podobně jako planety obíhají Slunce. Poprvé se to podařilo pracovníkům Univerzity v Rice v roce 2008. Zdroj: University of Rice. (avi, 1 MB)
Odkazy
J. J. Mestayer: Realization of Localized Bohr-Like Wave Packets; Phys. Rev. Lett. 100, 243004 (2008)
Rice University Press Release: Physicists create millimeter-sized "Bohr atom", 2008
P. Kulhánek: Kvantová teorie, studijní text pro doktorské studium, FEL ČVUT, 2001

